
Photo by Getty Images
じつは、再生医療は臨床応用への研究が本格化していく段階にあり、医療として普及する未来が着々と近づいてきているのです。時代の波に乗り遅れる前に、再生医療の基礎知識をマスターしましょう!
そもそも、再生医療とは?
再生医療とは、ひとことでいうならば、病気やケガで機能が失われた体の一部を特殊な細胞のチカラで再生させる医療のことです。
病気やケガで体の機能が失われるということは、つまり細胞がなくなる(もしくは細胞に異常が起きて働かなくなる)ということです。再生医療では、体外で人工的に培養した細胞、あるいは人工的に構築した臓器などの組織を移植し、失われた機能の修復・再生をします。
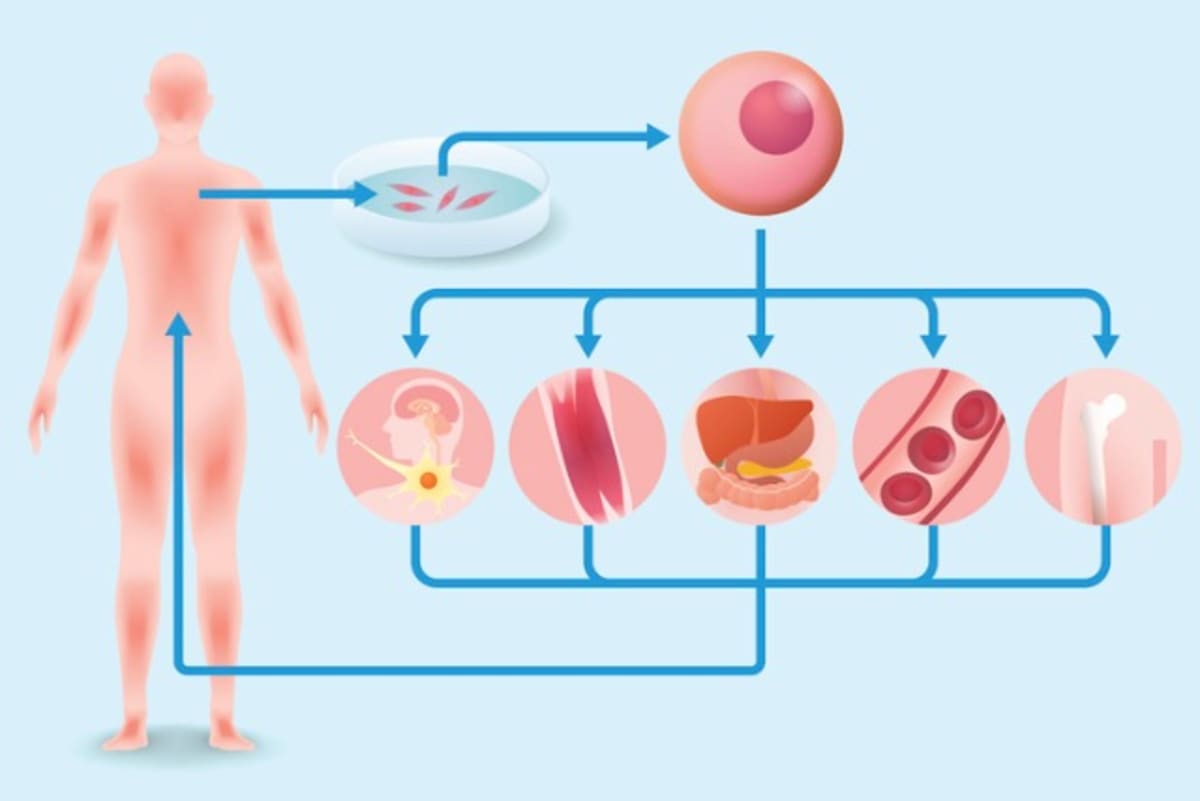
Photo by iStock
人間には、軽いケガなどを自然治癒する能力は備わっていますが、著しく機能を失ってしまった部分を再生することは困難です。そのため、人工関節を開発して埋め込んだり、臓器を移植したりといった手法が取られてきました。しかし、拒絶反応、感染症、ドナー不足など、課題やリスクもあります。
一方で、近年注目されている細胞を用いた再生医療は、体外で人工的に培養した細胞、あるいは人工的に構築した臓器などの組織を患者に移植し、臓器や組織など体の一部を再建する試みです。
医療機器や他人の臓器といった異物を使わずに、細胞を用いて本来の健康な状態に戻すということは、つまり「根治療法」が可能になるということで、多大な期待が寄せられています。脊髄損傷やパーキンソン病など難病の治療法が新たに確立されたり、治療期間の短縮によって患者のQOL(Quality of Life:生活の質)を向上させることにも可能性が広がります。

Photo by iStock
再生医療の定義は幅広いのですが、本記事では厚生労働省の定義を使用します。
1 患者の体外で人工的に培養した幹細胞等を、患者の体内に移植等することで、損傷した臓器や組織を再生し、失われた人体機能を回復させる医療。
2 ないしは、患者の体外において幹細胞等から人工的に構築した組織を、患者の体内に移植等することで、損傷した臓器や組織を再生し、失われた人体機能を回復させる医療。
(出所:厚生労働省・多能性幹細胞安全情報サイトより)
再生医療のカギを握る「幹細胞」
私たちの体は、さまざまな役割をもつ約60兆個もの細胞が集まってできています。人間の細胞は大きく分けて「生殖細胞」と「体細胞」に分けられます。「生殖細胞」は精子と卵子になる細胞です。一方「体細胞」は、生殖細胞以外のすべての細胞を差し、皮膚、血液、神経、臓器、骨など、それぞれの場所で適切な働きができるよう、異なる機能を担っています。
受精卵が分裂したばかりの頃の細胞は、まだ役割が定まっていませんが、「分化」を繰り返すことで、性質が変化し、それぞれの機能を持った「体細胞」になります。分化が完了した「体細胞」は、ほかの機能を持った細胞に分化することはありません。(細胞が様々な違う種類の細胞に変化する能力のことを「分化能」と呼び、多くの機能に分化できることを「多能性」と言います。)
ところで、細胞には寿命があります。皮膚や血液などが分かりやすい例ですが、常に新しい細胞を作り補充しないと維持できません。そのため、人間の体内には、新しい細胞を生み出す役割を持つ細胞があります。これを「幹細胞」と呼びます。
「幹細胞」は、傷ついたり古くなってしまった細胞を入れ替えるため、常に新たな細胞を作っています。幹細胞は分裂することで新しい細胞を生み出します。幹細胞が生み出した新しい細胞は、色々な細胞に変化(分化)することができます。体内のほとんどの細胞は、分裂の回数に限界があり、数十回分裂するとそれ以上分裂できなくなるのですが、幹細胞は無限に分裂することができます。

このように、幹細胞は、分化能を維持しながら無限に細胞分裂を繰り返し、新しい細胞を生み出す工場のような役割を果たしています。「分化能」と「自己複製能」の二つが幹細胞の大きな特色です。
再生医療では、主に幹細胞を培養して人工的に分化誘導することで、目的の細胞や組織を再生していくことを目指しています。
iPS細胞だけではない。再生医療に必要な幹細胞とは?
再生医療といえば「iPS細胞」というイメージがあります。iPS細胞は、どんな組織にも分化できる「万能細胞」で、なおかつ分化した体細胞から作製できるのが特徴です。京都大学の山中伸弥教授らによって開発されました。

Photo by Getty Images
iPS細胞が注目される理由をお伝えするために、まずはほかの幹細胞についてもご説明しましょう。
現在、再生医療に用いられている(または応用に向けて研究が進められている)幹細胞には、もともとヒトの体内に存在するものと、人工的に作られたものがあります。体内にある幹細胞は採取できる数が少なく、また体外で増殖・維持させるのが難しいため、1990年代に人工的に幹細胞が作製できるようになったことは非常に画期的なことでした。
代表的な幹細胞を下記に紹介します。
・成体幹細胞(体性幹細胞・組織幹細胞)
成体幹細胞は、体内に存在し、すでにある程度特定の機能に分化しています。いくつかの種類が見つかっており、たとえば、造血幹細胞は血液中にある赤血球や血小板などの血液細胞へ、上皮幹細胞は皮膚を構成する細胞へ、神経幹細胞は神経系の細胞へ、といった具合に特定の組織に向けてのみ分化します。
例外的に「間葉系幹細胞」(骨髄や脂肪組織に存在)は、骨、軟骨、血管など比較的幅広い組織に分化することができます。これらはヒトの体内にある細胞をほぼそのまま使用できるため、他の人工的な幹細胞に比べて低リスクです。
そのため、再生医療に用いられる幹細胞のなかではもっとも臨床への応用が進んでおり、実際に白血病の治療などに使われています。ちなみに、胎児の血液に含まれている幹細胞は臍帯血幹細胞と呼ばれ、出産後のへその緒からしか採取できないため希少ですが、造血幹細胞と間葉系幹細胞を含んでいます。
・ES細胞(胚性幹細胞)
ES細胞は、生体幹細胞と違ってあらゆる細胞に分化することができるため、多能性幹細胞とも呼ばれます。1998年にアメリカ・ウィスコンシン大学のジェームズ・トムソン氏によって樹立されました。
ES細胞のもとになるのは、胚のなかから取り出した幹細胞で、これを培養して作ります。胚とは、受精卵が分裂して胎児になるまでの段階のものです。つまり、ES細胞は胎児になる可能性を持った細胞から作ることになります。
不妊治療などで生じた余剰胚を用いるとはいえ倫理上の懸念も多く、日本では厳しく規制されていますが、世界的にみるとES細胞の研究は盛んに行われており、海外では治験も実施されています。
・iPS細胞(人工多能性幹細胞)
iPS細胞は、京都大学の山中伸弥教授らが開発した「多能性幹細胞」です。すでに分化した体細胞に、4種類の遺伝子(通称:山中ファクター)を導入し培養することで、人工的に未分化の状態に戻します(=リプログラミング)。「人工多能性幹細胞」の英語表記「induced pluripotent stem cell」から頭文字をとって、「iPS細胞」と名付けられました。
多能性はES細胞と同質といわれ、なおかつ倫理的な問題も払拭できたため世界的に注目を集めました。そして2012年、iPS細胞の開発の功績により山中教授がノーベル医学生理学賞を受賞したことは、日本において再生医療への注目度を一気に高めるきっかけとなりました。
ES細胞もiPS細胞も拒絶反応の問題や、作製・分化のプロセスでがん化しやすいなどの課題がありましたが、その後の研究の成果で徐々に克服されつつあります。
基礎研究の実験で様々な検証が終わったものは、そのあと臨床の現場で少数の患者さんの協力のもと、何年もかけて安全性や副作用を慎重に確認していくのですが(このプロセスを臨床研究という)、ようやく日本でもこの段階に到達するテーマが増えてきています。

*移植の適合性は免疫の型(HLA)が一致するかどうかで決まり、一致しない場合には拒絶反応がおきます。ES細胞は患者さん本人の細胞から作成することはできませんが、免疫の型が一致する細胞を利用する場合は拒絶反応を避けることが可能です。
急速な発展を遂げる再生医療
再生医療研究は今まさに、さまざまな臨床試験が実施されようとしています。難病の治療法が確立するなど、実用化がどんどん進んでいくことが期待されています。

細胞を使用した再生医療(細胞治療)は造血性幹細胞を患者に注入する白血病の治療から始まりました。
1970年代から細胞培養の技術が発達し、生きた細胞からシート状の組織を構築して人体に適応する技術が開発され始めました。とくに1993年以降、ロバート・ランガーとチャールズ・バカンティらが、生命科学と工学の融合ともいえるこの技術分野をティッシュエンジニアリングと名付けます。

ロバート・ランガー Photo by Getty Images
1998年にウィスコンシン大学でジェームズ・トムソンがES細胞を樹立すると、幹細胞を用いた再生医療の研究が世界中で加速します。すでに述べたとおり、ES細胞は倫理面の問題が残るため日本ではあまり研究が進まず、2007年に山中教授がiPS細胞を確立しました。
2014年にはiPS細胞から作製した網膜組織の細胞を移植する世界初の臨床研究が実施され、話題を集めました。この臨床研究では、滲出型加齢黄斑変性の患者に自己iPS細胞由来網膜色素上皮細胞シートが移植されています。
iPS細胞樹立から10年余り。現在脊髄損傷やパーキンソン病、重症心不全、血液などの領域でiPS細胞を使った臨床研究や治験が計画されており、国からの承認が下りれば開始される見通しです。また、ES細胞に関しても、国内初の治験が年内に始まります(2018年5月21日現在)。
iPS細胞やES細胞を使った再生医療の安全性が確立され、広く医療として普及するまでにはあと20年はかかると言われていますが、臨床応用への研究が本格化したのは大きな進展だと言えるでしょう。
〈本記事は「リケラボ」掲載分を編集し転載したものです。オリジナル記事はこちら〉
〈シリーズ第2回はこちら〉
〈シリーズ第3回はこちら〉
研究職をはじめとする理系人の生き方・働き方のヒントとなる情報を発信しています。
理想的な働き方を考えるためのエッセンスがいっぱいつまったリケラボで、人・仕事・生き方を一緒に考え、自分の理想の働き方を実現しませんか?
https://www.rikelab.jp/

